LP-184, der Prüfpräparatkandidat von Lantern Pharma, erhält von der FDA den zweiten Fast-Track-Status für die Behandlung von dreifach negativem Brustkrebs (TNBC)
DALLAS--(BUSINESS WIRE) 3. Dezember 2024 -- Lantern Pharma Inc. (NASDAQ: LTRN), ein Unternehmen für künstliche Intelligenz (KI), das sich der Entwicklung von Krebstherapien und der Veränderung von Kosten, Tempo und Zeitplan für onkologische Medikamente widmet Discovery and Development, gab heute bekannt, dass die FDA dem Prüfpräparat LP-184 den Fast-Track-Status für die Behandlung von dreifach negativem Brustkrebs (TNBC) erteilt hat. Dies ist die zweite Fast-Track-Auszeichnung für LP-184 im Jahr 2024, nach der Ausweisung für Glioblastom im Oktober.
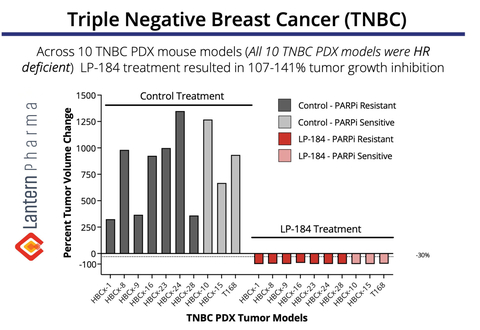
Über TNBC und den Bedarf an neuartigen Therapien
TNBC macht etwa 20 % aller Brustkrebserkrankungen aus und betrifft jährlich fast 29.000 Patientinnen in den USA. Die Prognose für TNBC-Patientinnen ist deutlich schlechter als bei hormonrezeptorpositivem Brustkrebs, wobei über 50 % der Patientinnen in den ersten 3–5 Jahren einen Rückfall erleiden und metastasierte TNBC-Patientinnen eine mittlere Gesamtüberlebenszeit von weniger als einem Jahr haben. Die derzeit verfügbaren Behandlungsmöglichkeiten sind begrenzt, insbesondere für Patienten, die eine Resistenz gegen bestehende Therapien entwickeln.
Überzeugende präklinische Daten belegen das Potenzial von LP-184 bei TNBC
Die obige Grafik zeigt die bemerkenswerte Antitumoraktivität von LP-184 in einer Gruppe von 10 von TNBC-Patienten stammenden Xenotransplantaten ( PDX)-Modelle. Bemerkenswert ist, dass LP-184 sowohl bei PARPi (PARP-Inhibitor)-resistenten als auch bei PARPi-empfindlichen Tumoren eine konsistente Wirksamkeit zeigte, wobei die Behandlung in allen getesteten Modellen zu einer vollständigen Tumorregression (107-141 % Hemmung des Tumorwachstums) führte. Diese Daten sind besonders bedeutsam, da sie auf das Potenzial von LP-184 als neuartige Therapieoption für TNBC-Patienten schließen lassen, einschließlich solcher, die eine Resistenz gegen bestehende PARP-Inhibitor-Behandlungen entwickelt haben – eine wachsende klinische Herausforderung in der TNBC-Therapie. Diese TNBC-Daten wurden erstmals auf dem San Antonio Breast Cancer Symposium im Jahr 2022 vorgestellt.
Der einzigartige Wirkmechanismus von LP-184 beruht auf der enzymatischen Aktivierung des Arzneimittels durch Prostaglandinreduktase 1 (PTGR1), die LP-184 speziell in Krebszellen in seine hochwirksame zytotoxische Form umwandelt. Die Analyse der RADR®-Plattform und anschließende In-vivo-Validierungsstudien haben gezeigt, dass PTGR1 in TNBC-Tumoren im Vergleich zu normalem Gewebe häufig erhöht ist, was diese Krebsarten besonders anfällig für die Behandlung mit LP-184 macht. Dieser Biomarker-gesteuerte Ansatz ermöglicht die potenzielle Identifizierung von Patienten, die am wahrscheinlichsten auf die LP-184-Therapie ansprechen, und steht im Einklang mit aktuellen und neuen Ansätzen der Präzisionsmedizin bei der TNBC-Behandlung.
Über LP-184
LP-184 ist ein niedermolekularer Medikamentenkandidat und Acylfulven der nächsten Generation, das vor allem die DNA in Krebszellen schädigt, die bestimmte Biomarker überexprimieren oder Mutationen in Reparaturwegen für DNA-Schäden aufweisen. LP-184 wurde mithilfe der proprietären RADR® AI-Plattform von Lantern entwickelt, um Patientenpopulationen und Krebssubtypen zu identifizieren, die das Potenzial haben, auf die Behandlung anzusprechen. Die Verbindung wird in mehreren soliden Tumoren untersucht, wo sie nanomolare Wirksamkeit und Aktivität bei arzneimittelresistenten Krebsarten gezeigt hat. LP-184 hat von der FDA den Orphan-Drug-Status für die Behandlung von Bauchspeicheldrüsenkrebs, Glioblastom (GBM) und ATRT erhalten und wurde außerdem für ATRT als seltene pädiatrische Erkrankung eingestuft.
Über uns Lantern Pharma
Lantern Pharma (NASDAQ: LTRN) ist ein KI-Unternehmen, das die Kosten, das Tempo und den Zeitplan für die Entdeckung und Entwicklung von Krebsmedikamenten verändert. Unsere proprietäre Plattform für KI und maschinelles Lernen (ML), RADR®, nutzt über 100 Milliarden onkologiebezogene Datenpunkte und eine Bibliothek mit mehr als 200 fortschrittlichen ML-Algorithmen, um bei der Lösung milliardenschwerer, realer Probleme bei der Entwicklung onkologischer Medikamente zu helfen. Durch die Nutzung der Leistungsfähigkeit der KI und mit dem Input erstklassiger wissenschaftlicher Berater und Mitarbeiter haben wir die Entwicklung unserer wachsenden Pipeline an Therapien beschleunigt, die mehrere Krebsindikationen abdecken, darunter sowohl solide Tumoren als auch Blutkrebs, und ein Antikörper-Wirkstoff-Konjugat (ADC). ) Programm. Zu unseren führenden Entwicklungsprogrammen gehören ein klinisches Phase-2-Programm und mehrere klinische Phase-1-Studien. Es wird geschätzt, dass unsere KI-gesteuerte Pipeline innovativer Produktkandidaten ein gemeinsames jährliches Marktpotenzial von über 15 Milliarden US-Dollar hat und das Potenzial hat, Hunderttausenden Krebspatienten auf der ganzen Welt lebensverändernde Therapien anzubieten.
Zukunftsgerichtete Erklärung:
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne von Abschnitt 27A des Securities Act von 1933 in der jeweils gültigen Fassung und Abschnitt 21E des Securities Exchange Act von 1934 in der jeweils gültigen Fassung. Zu diesen zukunftsgerichteten Aussagen gehören unter anderem Aussagen in Bezug auf: zukünftige Ereignisse oder unsere zukünftige finanzielle Leistung; die potenziellen Vorteile unserer RADR®-Plattform bei der Identifizierung von Medikamentenkandidaten und Patientenpopulationen, die wahrscheinlich auf einen Medikamentenkandidaten ansprechen; unsere strategischen Pläne, die Entwicklung unserer Arzneimittelkandidaten und unseres Entwicklungsprogramms für Antikörper-Wirkstoff-Konjugate (ADC) voranzutreiben; Schätzungen zum Entwicklungszeitpunkt für unsere Medikamentenkandidaten und das ADC-Entwicklungsprogramm; Erwartungen und Schätzungen hinsichtlich des Zeitplans für klinische Studien und der Patientenrekrutierung; unsere Forschungs- und Entwicklungsbemühungen unserer internen Arzneimittelforschungsprogramme und die Nutzung unserer RADR®-Plattform zur Rationalisierung des Arzneimittelentwicklungsprozesses; unsere Absicht, künstliche Intelligenz, maschinelles Lernen und Genomdaten zu nutzen, um das Tempo, das Risiko und die Kosten der Entdeckung und Entwicklung von Krebsmedikamenten zu rationalisieren und zu verändern und Patientenpopulationen zu identifizieren, die wahrscheinlich auf einen Medikamentenkandidaten ansprechen würden; Schätzungen zu Patientenpopulationen, potenziellen Märkten und potenziellen Marktgrößen; Umsatzschätzungen für unsere Medikamentenkandidaten und unsere Pläne, Medikamentenkandidaten zu entdecken und zu entwickeln und ihr kommerzielles Potenzial zu maximieren, indem wir solche Medikamentenkandidaten selbst oder in Zusammenarbeit mit anderen weiterentwickeln. Alle Aussagen, bei denen es sich nicht um Aussagen historischer Tatsachen handelt (einschließlich, aber nicht beschränkt auf Aussagen, die Wörter wie „antizipieren“, „glauben“, „erwägen“, „könnten“, „schätzen“, „erwarten“, „beabsichtigen“, „ suchen“, „können“, „könnte“, „planen“, „potenziell“, „vorhersagen“, „projizieren“, „Ziel“, „Modell“, „Ziel“, „Ziel“, „bevorstehend“, „sollte“, „wird“, „würde“ oder die Verneinung dieser Wörter oder andere ähnliche Ausdrücke) sollten als zukunftsgerichtete Aussagen betrachtet werden. Es gibt eine Reihe wichtiger Faktoren, die dazu führen können, dass unsere tatsächlichen Ergebnisse wesentlich von denen abweichen, die in den zukunftsgerichteten Aussagen zum Ausdruck gebracht werden, wie zum Beispiel (i) das Risiko, dass unsere Forschung und die Forschung unserer Mitarbeiter möglicherweise nicht erfolgreich sind, (ii) das Risiko, dass Beobachtungen in präklinischen Studien und frühe oder vorläufige Beobachtungen in klinischen Studien nicht gewährleisten, dass spätere Beobachtungen, Studien und Entwicklungen konsistent oder erfolgreich sind, (iii) das Risiko, dass wir bei Bedarf möglicherweise nicht in der Lage sind, ausreichende zukünftige Finanzierung sicherzustellen und soweit erforderlich, um unsere voranzutreiben und zu unterstützen bestehende und geplante klinische Studien und Operationen, (iv) das Risiko, dass es uns möglicherweise nicht gelingt, potenzielle Kandidaten zu lizenzieren oder potenzielle Partnerschaften und Kooperationen abzuschließen, (v) das Risiko, dass keiner unserer Produktkandidaten die Marktzulassung der FDA erhalten hat, und wir möglicherweise nicht in der Lage sein, klinische Tests für unsere Produktkandidaten erfolgreich einzuleiten, durchzuführen oder abzuschließen oder eine Marktzulassung für sie zu erhalten, (vi) das Risiko, dass kein auf unserer firmeneigenen RADR® AI-Plattform basierendes Arzneimittel die Marktzulassung der FDA erhalten hat oder anderweitig integriert wurde in ein kommerzielles Produkt umwandeln und (vii) die anderen Faktoren, die im Abschnitt „Risikofaktoren“ in unserem Jahresbericht auf Formular 10-K für das am 31. Dezember 2023 endende Geschäftsjahr aufgeführt sind und am 18. März 2024 bei der Securities and Exchange Commission eingereicht wurden. Sie können auf unseren Jahresbericht zugreifen auf Formular 10-K für das am 31. Dezember 2023 endende Geschäftsjahr unter der Registerkarte „Investor SEC Filings“ unserer Website unter www.lanternpharma.com oder auf der Website der SEC unter www.sec.gov. Angesichts dieser Risiken und Ungewissheiten können wir keine Garantie dafür geben, dass sich unsere zukunftsgerichteten Aussagen als richtig erweisen oder dass andere in unseren zukunftsgerichteten Aussagen prognostizierte oder in Betracht gezogene Ergebnisse oder Ereignisse tatsächlich eintreten werden, und wir warnen Anleger davor, dies zu tun sich unangemessen auf diese Aussagen verlassen. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung geben unsere Einschätzung zum Zeitpunkt der Veröffentlichung dieser Pressemitteilung wieder. Sofern gesetzlich nichts anderes vorgeschrieben ist, lehnen wir jegliche Verpflichtung ab, zukunftsgerichtete Aussagen zu aktualisieren, um die Aussage an tatsächliche Ergebnisse oder Änderungen unserer Erwartungen anzupassen .
Quelle: Lantern Pharma Inc.
Gesendet : 2024-12-04 06:00
Mehr lesen

- Harmony Biosciences erhält die Zulassung der US-amerikanischen Food and Drug Administration für Wakix (Pitolisant) zur Behandlung von Kataplexie bei pädiatrischer Narkolepsie
- Keytruda und Keytruda Qlex, plus Paclitaxel ± Bevacizumab, zugelassen für bestimmte Erwachsene mit PD-L1+ (CPS ≥1) platinresistentem Ovarialkarzinom
- NIH stoppt Teil einer klinischen Studie zur Bewertung einer möglichen Schlaganfallbehandlung
- Deciphera Pharmaceuticals gibt die Zustimmung der US-amerikanischen Food and Drug Administration zur Einreichung eines neuen Arzneimittelantrags für Tirabrutinib bei Patienten mit rezidiviertem oder refraktärem PCNSL bekannt
- Cumberland Pharmaceuticals erhält von der FDA den Fast-Track-Status für sein Ifetroban-Duchenne-Muskeldystrophie-Programm
- Die FDA genehmigt Rybrevant Faspro (Amivantamab und Hyaluronidase-Lpuj) als einzige EGFR-zielgerichtete Therapie, die einmal im Monat verabreicht werden kann
Haftungsausschluss
Es wurden alle Anstrengungen unternommen, um sicherzustellen, dass die von Drugslib.com bereitgestellten Informationen korrekt und aktuell sind aktuell und vollständig, eine Garantie hierfür kann jedoch nicht übernommen werden. Die hierin enthaltenen Arzneimittelinformationen können zeitkritisch sein. Die Informationen von Drugslib.com wurden für die Verwendung durch medizinisches Fachpersonal und Verbraucher in den Vereinigten Staaten zusammengestellt. Daher übernimmt Drugslib.com keine Gewähr dafür, dass eine Verwendung außerhalb der Vereinigten Staaten angemessen ist, sofern nicht ausdrücklich anders angegeben. Die Arzneimittelinformationen von Drugslib.com befürworten keine Arzneimittel, diagnostizieren keine Patienten und empfehlen keine Therapie. Die Arzneimittelinformationen von Drugslib.com sind eine Informationsquelle, die zugelassenen Ärzten bei der Betreuung ihrer Patienten helfen soll und/oder Verbrauchern dienen soll, die diesen Service als Ergänzung und nicht als Ersatz für die Fachkenntnisse, Fähigkeiten, Kenntnisse und Urteilsvermögen im Gesundheitswesen betrachten Praktiker.
Das Fehlen einer Warnung für ein bestimmtes Medikament oder eine bestimmte Medikamentenkombination sollte keinesfalls als Hinweis darauf ausgelegt werden, dass das Medikament oder die Medikamentenkombination für einen bestimmten Patienten sicher, wirksam oder geeignet ist. Drugslib.com übernimmt keinerlei Verantwortung für irgendeinen Aspekt der Gesundheitsversorgung, die mithilfe der von Drugslib.com bereitgestellten Informationen durchgeführt wird. Die hierin enthaltenen Informationen sollen nicht alle möglichen Verwendungen, Anweisungen, Vorsichtsmaßnahmen, Warnungen, Arzneimittelwechselwirkungen, allergischen Reaktionen oder Nebenwirkungen abdecken. Wenn Sie Fragen zu den Medikamenten haben, die Sie einnehmen, wenden Sie sich an Ihren Arzt, das medizinische Fachpersonal oder Ihren Apotheker.
Beliebte Schlüsselwörter
- metformin obat apa
- alahan panjang
- glimepiride obat apa
- takikardia adalah
- erau ernie
- pradiabetes
- besar88
- atrofi adalah
- kutu anjing
- trakeostomi
- mayzent pi
- enbrel auto injector not working
- enbrel interactions
- lenvima life expectancy
- leqvio pi
- what is lenvima
- lenvima pi
- empagliflozin-linagliptin
- encourage foundation for enbrel
- qulipta drug interactions
