El fármaco candidato en investigación de Lantern Pharma, LP-184, recibe la segunda designación de vía rápida de la FDA para el tratamiento del cáncer de mama triple negativo (TNBC)
DALLAS--(BUSINESS WIRE) 3 de diciembre de 2024: Lantern Pharma Inc. (NASDAQ: LTRN), una empresa de inteligencia artificial (IA) dedicada al desarrollo de terapias contra el cáncer y a transformar el costo, el ritmo y el cronograma de los medicamentos oncológicos. descubrimiento y desarrollo, anunció hoy que la FDA ha concedido la designación Fast Track al fármaco candidato en investigación, LP-184, para el tratamiento del cáncer de mama triple negativo (TNBC). Esta es la segunda designación Fast Track recibida para LP-184 en 2024, luego de su designación para glioblastoma en octubre.
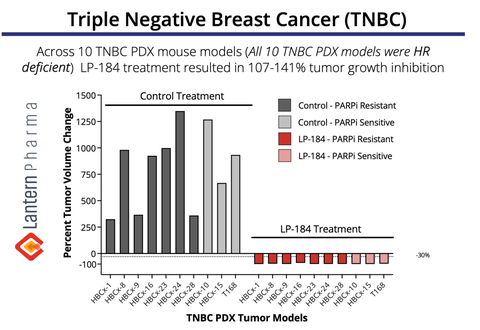
LP-184 demostró una regresión tumoral de 107-141 % en múltiples modelos TNBC PDX. (Gráfico: Business Wire)
LP-184 se encuentra actualmente en un ensayo clínico de Fase 1A diseñado para evaluar la seguridad y tolerabilidad de este fármaco experimental sintéticamente letal en una amplia gama de tumores sólidos, incluido el TNBC. LP-184 se optimizó y avanzó en parte con la plataforma de inteligencia artificial de Lantern, RADR®, que ayudó a validar mecanismos que podrían explotarse en el entorno clínico para erradicar cánceres desafiantes y descubrir conocimientos en poblaciones de pacientes específicas.
"Recepción una segunda designación de vía rápida de la FDA para LP-184 refuerza el importante potencial de este fármaco candidato para abordar necesidades críticas no satisfechas en cánceres agresivos, especialmente aquellos como el TNBC, donde los pacientes tienen opciones terapéuticas limitadas", afirmó Panna Sharma, Presidente y director ejecutivo de Lantern Pharma. "Los datos recientes presentados en la Cumbre de Inmuno-Oncología demostraron la capacidad de LP-184 para sensibilizar a los tumores TNBC que no responden a los inhibidores de puntos de control, lo que podría ampliar las opciones de tratamiento para pacientes con opciones terapéuticas limitadas".
Acerca del TNBC y la necesidad de nuevas terapias
El TNBC representa aproximadamente el 20% de todos los cánceres de mama y afecta a casi 29.000 pacientes anualmente en los EE. UU. El pronóstico para los pacientes con TNBC es considerablemente peor que el de los cánceres de mama con receptores hormonales positivos: más del 50% de los pacientes recaen en los primeros 3 a 5 años y los pacientes con TNBC metastásicos tienen una mediana de supervivencia general de menos de un año. Las opciones de tratamiento disponibles actualmente son limitadas, especialmente para los pacientes que desarrollan resistencia a las terapias existentes.
Datos preclínicos convincentes demuestran el potencial de LP-184 en TNBC
El gráfico anterior demuestra la notable actividad antitumoral de LP-184 en un panel de 10 xenoinjertos derivados de pacientes de TNBC ( PDX) modelos. En particular, LP-184 mostró una eficacia constante tanto en tumores resistentes a PARPi (inhibidor de PARP) como en tumores sensibles a PARPi, y el tratamiento dio como resultado una regresión tumoral completa (inhibición del crecimiento tumoral del 107-141%) en todos los modelos probados. Estos datos son particularmente significativos ya que sugieren el potencial de LP-184 como una nueva opción terapéutica para los pacientes con TNBC, incluidos aquellos que han desarrollado resistencia a los tratamientos existentes con inhibidores de PARP, un desafío clínico creciente en la terapia con TNBC. Estos datos de TNBC se presentaron inicialmente en el Simposio sobre cáncer de mama de San Antonio en 2022.
El mecanismo de acción único de LP-184 está impulsado por la activación enzimática del fármaco mediante la prostaglandina reductasa 1 (PTGR1), que convierte LP-184 en su forma citotóxica altamente potente específicamente dentro de las células cancerosas. El análisis de la plataforma RADR® y los estudios de validación in vivo posteriores han demostrado que PTGR1 está elevado con frecuencia en los tumores TNBC en comparación con el tejido normal, lo que hace que estos cánceres sean particularmente susceptibles al tratamiento con LP-184. Este enfoque basado en biomarcadores permite la posible identificación de los pacientes con mayor probabilidad de responder a la terapia LP-184, alineándose con los enfoques de medicina de precisión actuales y emergentes en el tratamiento del TNBC.
Acerca de LP-184
LP-184 es un candidato a fármaco de molécula pequeña y acilfulveno de próxima generación que daña preferentemente el ADN en las células cancerosas que sobreexpresan biomarcadores específicos o albergan mutaciones en las vías de reparación del daño del ADN. LP-184 se desarrolló utilizando la plataforma RADR® AI patentada de Lantern para identificar poblaciones de pacientes y subtipos de cáncer que tienen el potencial de responder al tratamiento. El compuesto se está evaluando en múltiples tumores sólidos donde ha demostrado potencia nanomolar y actividad en cánceres resistentes a los medicamentos. LP-184 ha recibido designaciones de medicamento huérfano de la FDA para el tratamiento del cáncer de páncreas, glioblastoma (GBM) y ATRT, y también se le ha otorgado una designación de enfermedad pediátrica rara para ATRT.
Acerca de Linterna Farma
Lantern Pharma (NASDAQ: LTRN) es una empresa de inteligencia artificial que transforma el costo, el ritmo y el cronograma del descubrimiento y desarrollo de fármacos oncológicos. Nuestra plataforma patentada de inteligencia artificial y aprendizaje automático (ML), RADR®, aprovecha más de 100 mil millones de puntos de datos centrados en la oncología y una biblioteca de más de 200 algoritmos avanzados de ML para ayudar a resolver problemas del mundo real valorados en miles de millones de dólares en el desarrollo de fármacos oncológicos. Aprovechando el poder de la IA y con el aporte de asesores y colaboradores científicos de primer nivel, hemos acelerado el desarrollo de nuestra creciente cartera de terapias que abarcan múltiples indicaciones de cáncer, incluidos tumores sólidos y cánceres de la sangre y un conjugado anticuerpo-fármaco (ADC). ) programa. Nuestros programas de desarrollo de líderes incluyen un programa clínico de Fase 2 y múltiples ensayos clínicos de Fase 1. Se estima que nuestra cartera de candidatos a productos innovadores impulsados por IA tiene un potencial de mercado anual combinado de más de $15 mil millones de dólares y tiene el potencial de proporcionar terapias que cambian la vida a cientos de miles de pacientes con cáncer en todo el mundo.
DECLARACIÓN A FUTURO:
Este comunicado de prensa contiene declaraciones prospectivas dentro del significado de la Sección 27A de la Ley de Valores de 1933, según enmendada, y la Sección 21E de la Ley de Bolsa de Valores de 1934, según enmendada. Estas declaraciones prospectivas incluyen, entre otras cosas, declaraciones relacionadas con: eventos futuros o nuestro desempeño financiero futuro; las ventajas potenciales de nuestra plataforma RADR® para identificar candidatos a fármacos y poblaciones de pacientes que probablemente respondan a un fármaco candidato; nuestros planes estratégicos para avanzar en el desarrollo de nuestros candidatos a fármacos y del programa de desarrollo de conjugados de anticuerpos y fármacos (ADC); estimaciones sobre el calendario de desarrollo de nuestros fármacos candidatos y el programa de desarrollo de ADC; expectativas y estimaciones con respecto al calendario de ensayos clínicos y la inscripción de pacientes; nuestros esfuerzos de investigación y desarrollo de nuestros programas internos de descubrimiento de fármacos y la utilización de nuestra plataforma RADR® para agilizar el proceso de desarrollo de fármacos; nuestra intención de aprovechar la inteligencia artificial, el aprendizaje automático y los datos genómicos para agilizar y transformar el ritmo, el riesgo y el costo del descubrimiento y desarrollo de fármacos oncológicos y para identificar poblaciones de pacientes que probablemente responderían a un fármaco candidato; estimaciones sobre poblaciones de pacientes, mercados potenciales y tamaños de mercado potenciales; estimaciones de ventas de nuestros fármacos candidatos y nuestros planes para descubrir y desarrollar fármacos candidatos y maximizar su potencial comercial mediante el avance de dichos fármacos candidatos nosotros mismos o en colaboración con otros. Cualquier declaración que no sea una declaración de hechos históricos (incluidas, entre otras, declaraciones que utilicen palabras como "anticipar", "creer", "contemplar", "podría", "estimar", "esperar", "pretender", " "buscar", "podría", "podría", "planificar", "potencial", "predecir", "proyectar", "objetivo", "modelo", "objetivo", "apuntar", "próximo". "debería", "hará", "haría" o el negativo de estas palabras u otras expresiones similares) deben considerarse declaraciones prospectivas. Hay una serie de factores importantes que podrían hacer que nuestros resultados reales difieran materialmente de los indicados en las declaraciones prospectivas, como (i) el riesgo de que nuestra investigación y la investigación de nuestros colaboradores no tengan éxito, (ii) el riesgo de que las observaciones en estudios preclínicos y las observaciones tempranas o preliminares en estudios clínicos no garanticen que las observaciones, los estudios y el desarrollo posteriores sean consistentes o exitosos, (iii) el riesgo de que no podamos asegurar suficiente financiamiento futuro cuando sea necesario y según sea necesario para avanzar y apoyar nuestra actual y operaciones y ensayos clínicos planificados, (iv) el riesgo de que no tengamos éxito en otorgar licencias a candidatos potenciales o en completar asociaciones y colaboraciones potenciales, (v) el riesgo de que ninguno de nuestros productos candidatos haya recibido la aprobación de comercialización de la FDA, y podemos no poder iniciar, realizar o concluir con éxito pruebas clínicas u obtener la aprobación de comercialización para nuestros productos candidatos, (vi) el riesgo de que ningún producto farmacológico basado en nuestra plataforma patentada de IA RADR® haya recibido la aprobación de comercialización de la FDA o se haya incorporado de otro modo a un producto comercial, y (vii) aquellos otros factores establecido en la sección Factores de riesgo de nuestro Informe Anual en el Formulario 10-K para el año finalizado el 31 de diciembre de 2023, presentado ante la Comisión de Bolsa y Valores el 18 de marzo de 2024. Puede acceder a nuestro Informe Anual en el Formulario 10-K para el año que finalizó el 31 de diciembre de 2023 en la pestaña de presentaciones de inversionistas ante la SEC de nuestro sitio web en www.lanternpharma.com o en el sitio web de la SEC en www.sec.gov. Dados estos riesgos e incertidumbres, no podemos garantizar que nuestras declaraciones prospectivas resulten ser precisas, o que cualquier otro resultado o evento proyectado o contemplado en nuestras declaraciones prospectivas de hecho ocurra, y advertimos a los inversores que no confiar indebidamente en estas declaraciones. Todas las declaraciones prospectivas contenidas en este comunicado de prensa representan nuestro juicio a la fecha del presente y, salvo que la ley exija lo contrario, renunciamos a cualquier obligación de actualizar cualquier declaración prospectiva para ajustar la declaración a los resultados reales o cambios en nuestras expectativas. .
Fuente: Lantern Pharma Inc.
Al corriente : 2024-12-04 06:00
Leer más

- Una universidad de Florida ha reportado más de 40 casos de sarampión
- La Administración de Alimentos y Medicamentos de EE. UU. acepta la solicitud de nuevo medicamento de Bristol Myers Squibb para Iberdomida en pacientes con mieloma múltiple en recaída o refractario
- BJ's Wholesale Club retira el salmón del mercado en siete estados de la costa este
- Satisfacción con semaglutida impulsada por una pérdida de peso eficaz
- Moderna recibe una carta de negativa a presentar una solicitud de la Administración de Alimentos y Medicamentos de EE. UU. para su vacuna contra la influenza estacional en investigación, mRNA-1010
- La FDA aprueba Rybrevant Faspro (amivantamab y hialuronidasa-lpuj) como la única terapia dirigida a EGFR que se puede administrar una vez al mes
Descargo de responsabilidad
Se ha hecho todo lo posible para garantizar que la información proporcionada por Drugslib.com sea precisa, hasta -fecha y completa, pero no se ofrece ninguna garantía a tal efecto. La información sobre medicamentos contenida en este documento puede ser urgente. La información de Drugslib.com ha sido compilada para uso de profesionales de la salud y consumidores en los Estados Unidos y, por lo tanto, Drugslib.com no garantiza que los usos fuera de los Estados Unidos sean apropiados, a menos que se indique específicamente lo contrario. La información sobre medicamentos de Drugslib.com no respalda medicamentos, ni diagnostica a pacientes ni recomienda terapias. La información sobre medicamentos de Drugslib.com es un recurso informativo diseñado para ayudar a los profesionales de la salud autorizados a cuidar a sus pacientes y/o para servir a los consumidores que ven este servicio como un complemento y no un sustituto de la experiencia, habilidad, conocimiento y criterio de la atención médica. practicantes.
La ausencia de una advertencia para un determinado medicamento o combinación de medicamentos de ninguna manera debe interpretarse como una indicación de que el medicamento o la combinación de medicamentos es seguro, eficaz o apropiado para un paciente determinado. Drugslib.com no asume ninguna responsabilidad por ningún aspecto de la atención médica administrada con la ayuda de la información que proporciona Drugslib.com. La información contenida en este documento no pretende cubrir todos los posibles usos, instrucciones, precauciones, advertencias, interacciones medicamentosas, reacciones alérgicas o efectos adversos. Si tiene preguntas sobre los medicamentos que está tomando, consulte con su médico, enfermera o farmacéutico.
Palabras clave populares
- metformin obat apa
- alahan panjang
- glimepiride obat apa
- takikardia adalah
- erau ernie
- pradiabetes
- besar88
- atrofi adalah
- kutu anjing
- trakeostomi
- mayzent pi
- enbrel auto injector not working
- enbrel interactions
- lenvima life expectancy
- leqvio pi
- what is lenvima
- lenvima pi
- empagliflozin-linagliptin
- encourage foundation for enbrel
- qulipta drug interactions
