Le médicament candidat expérimental de Lantern Pharma, LP-184, reçoit une deuxième désignation accélérée de la FDA pour le traitement du cancer du sein triple négatif (TNBC)
DALLAS--(BUSINESS WIRE) 3 décembre 2024 -- Lantern Pharma Inc. (NASDAQ : LTRN), une société d'intelligence artificielle (IA) dédiée au développement de thérapies contre le cancer et à la transformation du coût, du rythme et du calendrier des médicaments oncologiques. découverte et développement, a annoncé aujourd'hui que la FDA a accordé la désignation Fast Track au candidat médicament expérimental, LP-184, pour le traitement du cancer du sein triple négatif (TNBC). Il s'agit de la deuxième désignation Fast Track reçue pour le LP-184 en 2024, après sa désignation pour le glioblastome en octobre.
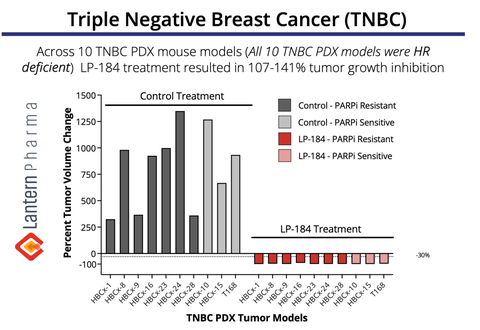
Le LP-184 a démontré une régression tumorale de 107 à 141 % dans plusieurs modèles TNBC PDX. (Graphique : Business Wire)
Le LP-184 fait actuellement l'objet d'un essai clinique de phase 1A visant à évaluer l'innocuité et la tolérabilité de ce médicament expérimental synthétiquement mortel dans un large éventail de tumeurs solides, y compris le TNBC. Le LP-184 a été optimisé et avancé en partie grâce à la plateforme d'IA de Lantern, RADR®, qui a permis de valider des mécanismes pouvant être exploités en milieu clinique pour éradiquer des cancers difficiles et découvrir des informations sur des populations de patients ciblées.
"Réception une deuxième désignation Fast Track de la FDA pour le LP-184 renforce le potentiel significatif de ce candidat médicament pour répondre aux besoins critiques non satisfaits dans les cancers agressifs, en particulier ceux comme le TNBC où les patients ont des options thérapeutiques limitées, " a déclaré Panna Sharma, présidente et PDG de Lantern Pharma. "Des données récentes présentées lors du Sommet d'immuno-oncologie ont démontré la capacité du LP-184 à sensibiliser les tumeurs TNBC qui ne répondent pas aux inhibiteurs de point de contrôle, élargissant ainsi potentiellement les options de traitement pour les patients ayant des choix thérapeutiques limités."
À propos du TNBC et du besoin de nouvelles thérapies
Le TNBC représente environ 20 % de tous les cancers du sein, touchant près de 29 000 patientes chaque année aux États-Unis. Le pronostic des patientes TNBC est considérablement pire que celui des cancers du sein à récepteurs hormonaux positifs, avec plus de 50 % des patientes rechutant au cours des 3 à 5 premières années et les patientes TNBC métastatiques ayant une survie globale médiane inférieure à un an. Les options de traitement actuellement disponibles sont limitées, en particulier pour les patients qui développent une résistance aux thérapies existantes.
Des données précliniques convaincantes démontrent le potentiel du LP-184 dans le TNBC
Le graphique ci-dessus démontre l'activité antitumorale remarquable du LP-184 sur un panel de 10 xénogreffes dérivées de patients TNBC ( PDX). Notamment, le LP-184 a montré une efficacité constante dans les tumeurs résistantes au PARPi (inhibiteur de PARP) et sensibles au PARPi, le traitement entraînant une régression complète de la tumeur (inhibition de la croissance tumorale de 107 à 141 %) dans tous les modèles testés. Ces données sont particulièrement significatives car elles suggèrent le potentiel du LP-184 en tant que nouvelle option thérapeutique pour les patients atteints de TNBC, y compris ceux qui ont développé une résistance aux traitements inhibiteurs de PARP existants - un défi clinique croissant dans le traitement du TNBC. Ces données TNBC ont été initialement présentées lors du San Antonio Breast Cancer Symposium en 2022.
Le mécanisme d'action unique du LP-184 repose sur l'activation enzymatique du médicament par la prostaglandine réductase 1 (PTGR1), qui convertit le LP-184 en sa forme cytotoxique très puissante, spécifiquement dans les cellules cancéreuses. L'analyse de la plateforme RADR® et les études de validation in vivo ultérieures ont montré que le PTGR1 est fréquemment élevé dans les tumeurs TNBC par rapport aux tissus normaux, ce qui rend ces cancers particulièrement sensibles au traitement par LP-184. Cette approche basée sur les biomarqueurs permet d'identifier potentiellement les patients les plus susceptibles de répondre au traitement par LP-184, en s'alignant sur les approches actuelles et émergentes de médecine de précision dans le traitement du TNBC.
À propos du LP-184
LP-184 est un candidat-médicament à petites molécules et un acylfulvène de nouvelle génération qui endommage préférentiellement l'ADN des cellules cancéreuses qui surexpriment des biomarqueurs spécifiques ou abritent des mutations dans les voies de réparation des dommages à l'ADN. Le LP-184 a été développé à l'aide de la plateforme RADR® AI exclusive de Lantern pour identifier les populations de patients et les sous-types de cancer susceptibles de répondre au traitement. Le composé est en cours d’évaluation dans plusieurs tumeurs solides où il a montré une puissance et une activité nanomolaire dans les cancers résistants aux médicaments. Le LP-184 a reçu la désignation de médicament orphelin de la FDA pour le traitement du cancer du pancréas, du glioblastome (GBM) et de l'ATRT, et a également obtenu la désignation de maladie pédiatrique rare pour l'ATRT.
À propos Lanterne Pharma
Lantern Pharma (NASDAQ : LTRN) est une société d'IA qui transforme le coût, le rythme et le calendrier de la découverte et du développement de médicaments oncologiques. Notre plateforme exclusive d'IA et d'apprentissage automatique (ML), RADR®, exploite plus de 100 milliards de points de données axés sur l'oncologie et une bibliothèque de plus de 200 algorithmes avancés d'apprentissage automatique pour aider à résoudre des problèmes réels d'un milliard de dollars dans le développement de médicaments oncologiques. En exploitant la puissance de l'IA et avec la contribution de conseillers et collaborateurs scientifiques de classe mondiale, nous avons accéléré le développement de notre portefeuille croissant de thérapies couvrant plusieurs indications de cancer, y compris les tumeurs solides et les cancers du sang, ainsi qu'un conjugué anticorps-médicament (ADC). ) programme. Nos principaux programmes de développement comprennent un programme clinique de phase 2 et plusieurs essais cliniques de phase 1. On estime que notre portefeuille de produits candidats innovants, basé sur l'IA, a un potentiel de marché annuel combiné de plus de 15 milliards de dollars américains et a le potentiel de fournir des thérapies qui changent la vie de centaines de milliers de patients atteints de cancer à travers le monde.
Déclaration prospective :
Ce communiqué de presse contient des déclarations prospectives au sens de l'article 27A du Securities Act de 1933, tel que modifié, et de l'article 21E du Securities Exchange Act de 1934, tel que modifié. Ces déclarations prospectives comprennent, entre autres choses, des déclarations relatives à : des événements futurs ou nos performances financières futures ; les avantages potentiels de notre plateforme RADR® pour identifier les candidats médicaments et les populations de patients susceptibles de répondre à un candidat médicament ; nos plans stratégiques pour faire progresser le développement de nos candidats médicaments et de notre programme de développement de conjugués anticorps-médicament (ADC) ; des estimations concernant le calendrier de développement de nos candidats médicaments et de notre programme de développement d'ADC ; les attentes et les estimations concernant le calendrier des essais cliniques et le recrutement des patients ; nos efforts de recherche et développement de nos programmes internes de découverte de médicaments et l'utilisation de notre plateforme RADR® pour rationaliser le processus de développement de médicaments ; notre intention de tirer parti de l'intelligence artificielle, de l'apprentissage automatique et des données génomiques pour rationaliser et transformer le rythme, les risques et les coûts de la découverte et du développement de médicaments oncologiques et pour identifier les populations de patients susceptibles de répondre à un candidat-médicament ; des estimations concernant les populations de patients, les marchés potentiels et la taille potentielle des marchés ; les estimations des ventes de nos candidats-médicaments et nos projets visant à découvrir et à développer des candidats-médicaments et à maximiser leur potentiel commercial en faisant progresser ces candidats-médicaments nous-mêmes ou en collaboration avec d'autres. Toute déclaration qui n'est pas une déclaration de fait historique (y compris, sans s'y limiter, les déclarations qui utilisent des mots tels que « anticiper », « croire », « contempler », « pourrait », « estimer », « s'attendre à », « avoir l'intention de », « chercher", "peut", "pourrait", "planifier", "potentiel", "prédire", "projet", "cible", "modèle", "objectif", "but", "à venir", "devrait", "sera", "serait" ou la forme négative de ces mots ou d'autres expressions similaires) doivent être considérés comme des déclarations prospectives. Il existe un certain nombre de facteurs importants qui pourraient faire en sorte que nos résultats réels diffèrent sensiblement de ceux indiqués dans les déclarations prospectives, tels que (i) le risque que nos recherches et celles de nos collaborateurs échouent, (ii) le risque que les observations dans les études précliniques et les observations précoces ou préliminaires dans les études cliniques ne garantissent pas que les observations, études et développements ultérieurs seront cohérents ou réussis, (iii) le risque que nous ne soyons pas en mesure d'obtenir un financement futur suffisant en cas de besoin et au besoin pour faire avancer et soutenir nos essais cliniques existants et prévus et opérations, (iv) le risque que nous ne parvenions pas à autoriser des candidats potentiels ou à conclure des partenariats et des collaborations potentiels, (v) le risque qu'aucun de nos produits candidats n'ait reçu l'approbation de commercialisation de la FDA, et que nous puissions ne pas être en mesure de lancer, mener ou conclure avec succès des tests cliniques ou obtenir l'approbation de commercialisation de nos produits candidats, (vi) le risque qu'aucun produit médicamenteux basé sur notre plateforme exclusive RADR® AI n'ait reçu l'approbation de commercialisation de la FDA ou n'ait été autrement incorporé dans un produit commercial, et (vii) les autres facteurs énoncés dans la section Facteurs de risque. dans notre rapport annuel sur formulaire 10-K pour l'exercice clos le 31 décembre 2023, déposé auprès de la Securities and Exchange Commission le 18 mars 2024. Vous pouvez accéder à notre rapport annuel sur formulaire 10-K pour l'exercice clos le 31 décembre 2023. sous l'onglet des dépôts des investisseurs auprès de la SEC de notre site Web à l'adresse www.lanternpharma.com ou sur le site Web de la SEC à l'adresse www.sec.gov. Compte tenu de ces risques et incertitudes, nous ne pouvons garantir que nos déclarations prospectives se révéleront exactes, ou que tout autre résultat ou événement projeté ou envisagé par nos déclarations prospectives se produira effectivement, et nous avertissons les investisseurs de ne pas se fier indûment à ces déclarations. Toutes les déclarations prospectives contenues dans ce communiqué de presse représentent notre jugement à la date des présentes et, sauf disposition contraire de la loi, nous déclinons toute obligation de mettre à jour les déclarations prospectives pour les conformer aux résultats réels ou aux changements de nos attentes. .
Source : Lantern Pharma Inc.
Publié : 2024-12-04 06:00
En savoir plus

- Migraine fréquente chez les femmes atteintes de macromastie et de maux de tête
- Homicide, suicide et surdose, principales causes de décès maternel
- La FDA s'oriente vers des approbations de médicaments plus rapides
- Un implant cérébral peut lire les mouvements des patients atteints de la maladie de Parkinson, ouvrant ainsi la porte à un traitement plus efficace
- Le GLP-1 RA PF'3944 injectable à action ultra-longue de Pfizer montre une perte de poids robuste et continue avec une administration mensuelle dans le cadre d'un essai de phase 2b
- Bhattacharya fera double emploi à la tête du CDC et du NIH
Avis de non-responsabilité
Tous les efforts ont été déployés pour garantir que les informations fournies par Drugslib.com sont exactes, jusqu'à -date et complète, mais aucune garantie n'est donnée à cet effet. Les informations sur les médicaments contenues dans ce document peuvent être sensibles au facteur temps. Les informations de Drugslib.com ont été compilées pour être utilisées par des professionnels de la santé et des consommateurs aux États-Unis et, par conséquent, Drugslib.com ne garantit pas que les utilisations en dehors des États-Unis sont appropriées, sauf indication contraire spécifique. Les informations sur les médicaments de Drugslib.com ne cautionnent pas les médicaments, ne diagnostiquent pas les patients et ne recommandent pas de thérapie. Les informations sur les médicaments de Drugslib.com sont une ressource d'information conçue pour aider les professionnels de la santé agréés à prendre soin de leurs patients et/ou pour servir les consommateurs qui considèrent ce service comme un complément et non un substitut à l'expertise, aux compétences, aux connaissances et au jugement des soins de santé. praticiens.
L'absence d'avertissement pour un médicament ou une combinaison de médicaments donné ne doit en aucun cas être interprétée comme indiquant que le médicament ou la combinaison de médicaments est sûr, efficace ou approprié pour un patient donné. Drugslib.com n'assume aucune responsabilité pour aucun aspect des soins de santé administrés à l'aide des informations fournies par Drugslib.com. Les informations contenues dans le présent document ne sont pas destinées à couvrir toutes les utilisations, instructions, précautions, avertissements, interactions médicamenteuses, réactions allergiques ou effets indésirables possibles. Si vous avez des questions sur les médicaments que vous prenez, consultez votre médecin, votre infirmière ou votre pharmacien.
Mots-clés populaires
- metformin obat apa
- alahan panjang
- glimepiride obat apa
- takikardia adalah
- erau ernie
- pradiabetes
- besar88
- atrofi adalah
- kutu anjing
- trakeostomi
- mayzent pi
- enbrel auto injector not working
- enbrel interactions
- lenvima life expectancy
- leqvio pi
- what is lenvima
- lenvima pi
- empagliflozin-linagliptin
- encourage foundation for enbrel
- qulipta drug interactions
