Il farmaco candidato sperimentale di Lantern Pharma, LP-184, riceve la seconda designazione Fast Track dalla FDA per il trattamento del cancro al seno triplo negativo (TNBC)
DALLAS--(BUSINESS WIRE) 3 dicembre 2024 -- Lantern Pharma Inc. (NASDAQ: LTRN), una società di intelligenza artificiale (AI) impegnata nello sviluppo di terapie antitumorali e nella trasformazione dei costi, dei ritmi e delle tempistiche dei farmaci oncologici scoperta e sviluppo, ha annunciato oggi che la FDA ha concesso la designazione Fast Track al farmaco candidato in fase di sperimentazione, LP-184, per il trattamento del cancro al seno triplo negativo (TNBC). Si tratta della seconda designazione Fast Track ricevuta per LP-184 nel 2024, dopo la designazione per glioblastoma in ottobre.
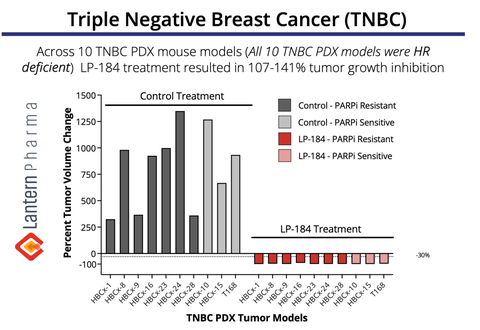
LP-184 ha dimostrato una regressione del tumore del 107-141% in più modelli TNBC PDX. (Grafica: Business Wire)
LP-184 è attualmente oggetto di uno studio clinico di Fase 1A progettato per valutare la sicurezza e la tollerabilità di questo candidato farmaco sperimentale sinteticamente letale in un'ampia gamma di tumori solidi, compreso il TNBC. LP-184 è stato ottimizzato e avanzato in parte con la piattaforma AI di Lantern, RADR®, che ha contribuito a convalidare meccanismi che potrebbero essere sfruttati in ambito clinico per sradicare tumori impegnativi e scoprire informazioni dettagliate su popolazioni di pazienti mirate.
"Ricezione in corso una seconda designazione Fast Track della FDA per LP-184 rafforza il potenziale significativo di questo farmaco candidato per affrontare i bisogni critici insoddisfatti nei tumori aggressivi, in particolare quelli come il TNBC, dove i pazienti hanno opzioni terapeutiche limitate," ha affermato Panna Sharma, Presidente e CEO di Lantern Pharma. "Dati recenti presentati all'Immuno-Oncology Summit hanno dimostrato la capacità di LP-184 di sensibilizzare i tumori TNBC che non rispondono agli inibitori del checkpoint, ampliando potenzialmente le opzioni di trattamento per i pazienti con scelte terapeutiche limitate."
Il TNBC e la necessità di nuove terapie
Il TNBC rappresenta circa il 20% di tutti i tumori al seno e colpisce quasi 29.000 pazienti ogni anno negli Stati Uniti. La prognosi per i pazienti con TNBC è considerevolmente peggiore rispetto ai tumori al seno con recettori ormonali positivi, con oltre il 50% dei pazienti che recidivano nei primi 3-5 anni e i pazienti con TNBC metastatico che hanno una sopravvivenza globale mediana inferiore a un anno. Le opzioni terapeutiche attualmente disponibili sono limitate, in particolare per i pazienti che sviluppano resistenza alle terapie esistenti.
Dati preclinici convincenti dimostrano il potenziale di LP-184 nel TNBC
Il grafico sopra dimostra la notevole attività antitumorale di LP-184 su un pannello di 10 xenotrapianti derivati da pazienti TNBC ( modelli PDX). In particolare, LP-184 ha mostrato un’efficacia costante sia nei tumori resistenti a PARPi (inibitore di PARP) che in quelli sensibili a PARPi, con il trattamento che ha portato a una completa regressione del tumore (inibizione della crescita del tumore del 107-141%) in tutti i modelli testati. Questi dati sono particolarmente significativi in quanto suggeriscono il potenziale di LP-184 come nuova opzione terapeutica per i pazienti con TNBC, compresi quelli che hanno sviluppato resistenza ai trattamenti esistenti con inibitori di PARP, una sfida clinica crescente nella terapia con TNBC. Questi dati TNBC sono stati inizialmente presentati al San Antonio Breast Cancer Symposium nel 2022.
L'esclusivo meccanismo d'azione di LP-184 è guidato dall'attivazione enzimatica del farmaco da parte della prostaglandina reduttasi 1 (PTGR1), che converte LP-184 nella sua forma citotossica altamente potente specificatamente all'interno delle cellule tumorali. L’analisi della piattaforma RADR® e i successivi studi di validazione in vivo hanno dimostrato che PTGR1 è spesso elevato nei tumori TNBC rispetto al tessuto normale, rendendo questi tumori particolarmente suscettibili al trattamento con LP-184. Questo approccio basato sui biomarcatori consente la potenziale identificazione dei pazienti che hanno maggiori probabilità di rispondere alla terapia con LP-184, allineandosi con gli approcci attuali ed emergenti della medicina di precisione nel trattamento del TNBC.
Informazioni su LP-184
LP-184 è un candidato farmaco a piccola molecola e acilfulvene di nuova generazione che danneggia preferenzialmente il DNA nelle cellule tumorali che sovraesprimono biomarcatori specifici o che ospitano mutazioni nei percorsi di riparazione del danno del DNA. LP-184 è stato sviluppato utilizzando la piattaforma AI RADR® proprietaria di Lantern per identificare le popolazioni di pazienti e i sottotipi di cancro che hanno il potenziale per rispondere al trattamento. Il composto è in fase di valutazione in molteplici tumori solidi dove ha mostrato potenza e attività nanomolari nei tumori resistenti ai farmaci. LP-184 ha ricevuto la designazione di farmaco orfano dalla FDA per il trattamento del cancro del pancreas, del glioblastoma (GBM) e dell'ATRT, e gli è stata anche concessa la designazione di malattia pediatrica rara per l'ATRT.
Informazioni Lantern Pharma
Lantern Pharma (NASDAQ: LTRN) è una società di intelligenza artificiale che sta trasformando i costi, i ritmi e le tempistiche della scoperta e dello sviluppo di farmaci oncologici. La nostra piattaforma proprietaria di intelligenza artificiale e machine learning (ML), RADR®, sfrutta oltre 100 miliardi di punti dati incentrati sull'oncologia e una libreria di oltre 200 algoritmi ML avanzati per aiutare a risolvere problemi reali da miliardi di dollari nello sviluppo di farmaci oncologici. Sfruttando la potenza dell'intelligenza artificiale e con il contributo di consulenti e collaboratori scientifici di livello mondiale, abbiamo accelerato lo sviluppo della nostra crescente pipeline di terapie che abbracciano molteplici indicazioni tumorali, inclusi tumori solidi e tumori del sangue e un coniugato anticorpo-farmaco (ADC ) programma. I nostri programmi di sviluppo principali includono un programma clinico di Fase 2 e numerosi studi clinici di Fase 1. Si stima che la nostra pipeline di prodotti innovativi basati sull'intelligenza artificiale abbia un potenziale di mercato annuo combinato di oltre 15 miliardi di dollari e abbia il potenziale per fornire terapie che cambiano la vita a centinaia di migliaia di malati di cancro in tutto il mondo.
DICHIARAZIONE PREGIUDIZIATA:
Il presente comunicato stampa contiene dichiarazioni previsionali ai sensi della Sezione 27A del Securities Act del 1933, come modificato, e della Sezione 21E del Securities Exchange Act del 1934, come modificato. Queste dichiarazioni previsionali includono, tra le altre cose, dichiarazioni relative a: eventi futuri o la nostra futura performance finanziaria; i potenziali vantaggi della nostra piattaforma RADR® nell'identificazione di farmaci candidati e di popolazioni di pazienti che potrebbero rispondere a un farmaco candidato; i nostri piani strategici per promuovere lo sviluppo dei nostri farmaci candidati e il programma di sviluppo del coniugato farmaco-anticorpo (ADC); stime relative ai tempi di sviluppo dei nostri farmaci candidati e al programma di sviluppo ADC; aspettative e stime riguardanti i tempi della sperimentazione clinica e l'arruolamento dei pazienti; i nostri sforzi di ricerca e sviluppo dei nostri programmi interni di scoperta di farmaci e l'utilizzo della nostra piattaforma RADR® per semplificare il processo di sviluppo dei farmaci; la nostra intenzione di sfruttare l’intelligenza artificiale, l’apprendimento automatico e i dati genomici per semplificare e trasformare il ritmo, il rischio e i costi della scoperta e dello sviluppo di farmaci oncologici e per identificare le popolazioni di pazienti che probabilmente risponderebbero a un candidato farmaco; stime riguardanti popolazioni di pazienti, mercati potenziali e dimensioni potenziali del mercato; stime di vendita dei nostri farmaci candidati e i nostri piani per scoprire e sviluppare farmaci candidati e per massimizzare il loro potenziale commerciale promuovendo tali farmaci candidati noi stessi o in collaborazione con altri. Qualsiasi dichiarazione che non sia una dichiarazione di fatti storici (incluse, senza limitazioni, dichiarazioni che utilizzano parole come "anticipare", "credere", "contemplare", "potrebbe", "stimare", "aspettarsi", "intendere" " cercare", "può", "potrebbe", "pianificare", "potenziale", "prevedere", "progetto", "obiettivo", "modello", "obiettivo", "scopo", "imminente", "dovrebbe", "sarà", "farebbe" o il negativo di queste parole o altre espressioni simili) devono essere considerate dichiarazioni previsionali. Esistono numerosi fattori importanti che potrebbero far sì che i nostri risultati effettivi differiscano sostanzialmente da quelli indicati nelle dichiarazioni previsionali, come (i) il rischio che la nostra ricerca e quella dei nostri collaboratori potrebbero non avere successo, (ii) il rischio che le osservazioni negli studi preclinici e le osservazioni iniziali o preliminari negli studi clinici non garantiscano che le osservazioni, gli studi e lo sviluppo successivi saranno coerenti o di successo, (iii) il rischio che potremmo non essere in grado di garantire finanziamenti futuri sufficienti quando necessario e come richiesto per portare avanti e sostenere le nostre attività esistenti e pianificate sperimentazioni e operazioni cliniche, (iv) il rischio che potremmo non riuscire a concedere licenze a potenziali candidati o a completare potenziali partnership e collaborazioni, (v) il rischio che nessuno dei nostri prodotti candidati abbia ricevuto l'approvazione alla commercializzazione da parte della FDA e potremmo non essere in grado di avviare, condurre o concludere con successo test clinici o ottenere l'approvazione alla commercializzazione per i nostri prodotti candidati, (vi) il rischio che nessun prodotto farmaceutico basato sulla nostra piattaforma proprietaria RADR® AI abbia ricevuto l'approvazione alla commercializzazione dalla FDA o sia stato altrimenti incorporato in uno spot pubblicitario prodotto e (vii) gli altri fattori indicati nella sezione Fattori di rischio della nostra relazione annuale sul modulo 10-K per l'anno terminato il 31 dicembre 2023, depositata presso la Securities and Exchange Commission il 18 marzo 2024. Puoi accedere alla nostra relazione annuale sul modulo 10-K per l'anno si è concluso il 31 dicembre 2023 nella scheda Documenti SEC per gli investitori del nostro sito Web all'indirizzo www.lanternpharma.com o sul sito Web della SEC all'indirizzo www.sec.gov. Considerati questi rischi e incertezze, non possiamo fornire alcuna garanzia che le nostre dichiarazioni previsionali si riveleranno accurate o che qualsiasi altro risultato o evento previsto o contemplato dalle nostre dichiarazioni previsionali si verificherà effettivamente e avvertiamo gli investitori di non fare eccessivo affidamento su queste affermazioni. Tutte le dichiarazioni previsionali contenute nel presente comunicato stampa rappresentano il nostro giudizio alla data odierna e, salvo quanto diversamente richiesto dalla legge, decliniamo qualsiasi obbligo di aggiornare qualsiasi dichiarazione previsionale per conformare la dichiarazione ai risultati effettivi o ai cambiamenti nelle nostre aspettative .
Fonte: Lantern Pharma Inc.
Pubblicato : 2024-12-04 06:00
Per saperne di più

- Il rendering del volume del miocardio e delle valvole cardiache consente la visualizzazione
- Deciphera Pharmaceuticals annuncia l'accettazione da parte della Food and Drug Administration statunitense della presentazione della domanda per un nuovo farmaco per tirabrutinib in pazienti con PCNSL recidivante o refrattario
- Soddisfazione con Semaglutide guidata da un'efficace perdita di peso
- Bevande zuccherate collegate a una maggiore ansia negli adolescenti
- Fenebrutinib di Genentech è il primo farmaco sperimentale in oltre un decennio che riduce la progressione della disabilità nella sclerosi multipla primariamente progressiva (PPMS)
- Bhattacharya svolgerà il doppio compito alla guida di CDC e NIH
Disclaimer
È stato fatto ogni sforzo per garantire che le informazioni fornite da Drugslib.com siano accurate, aggiornate -datati e completi, ma non viene fornita alcuna garanzia in tal senso. Le informazioni sui farmaci qui contenute potrebbero essere sensibili al fattore tempo. Le informazioni su Drugslib.com sono state compilate per l'uso da parte di operatori sanitari e consumatori negli Stati Uniti e pertanto Drugslib.com non garantisce che l'uso al di fuori degli Stati Uniti sia appropriato, se non diversamente indicato. Le informazioni sui farmaci di Drugslib.com non sostengono farmaci, né diagnosticano pazienti né raccomandano terapie. Le informazioni sui farmaci di Drugslib.com sono una risorsa informativa progettata per assistere gli operatori sanitari autorizzati nella cura dei propri pazienti e/o per servire i consumatori che considerano questo servizio come un supplemento e non come un sostituto dell'esperienza, dell'abilità, della conoscenza e del giudizio dell'assistenza sanitaria professionisti.
L'assenza di un'avvertenza per un determinato farmaco o combinazione di farmaci non deve in alcun modo essere interpretata come indicazione che il farmaco o la combinazione di farmaci sia sicura, efficace o appropriata per un dato paziente. Drugslib.com non si assume alcuna responsabilità per qualsiasi aspetto dell'assistenza sanitaria amministrata con l'aiuto delle informazioni fornite da Drugslib.com. Le informazioni contenute nel presente documento non intendono coprire tutti i possibili usi, indicazioni, precauzioni, avvertenze, interazioni farmacologiche, reazioni allergiche o effetti avversi. Se hai domande sui farmaci che stai assumendo, consulta il tuo medico, infermiere o farmacista.
Parole chiave popolari
- metformin obat apa
- alahan panjang
- glimepiride obat apa
- takikardia adalah
- erau ernie
- pradiabetes
- besar88
- atrofi adalah
- kutu anjing
- trakeostomi
- mayzent pi
- enbrel auto injector not working
- enbrel interactions
- lenvima life expectancy
- leqvio pi
- what is lenvima
- lenvima pi
- empagliflozin-linagliptin
- encourage foundation for enbrel
- qulipta drug interactions
