Lantern Pharma's kandidaat-geneesmiddel voor onderzoek, LP-184, ontvangt tweede fast track-status van de FDA voor de behandeling van drievoudige negatieve borstkanker (TNBC)
DALLAS--(BUSINESS WIRE) 3 december 2024 -- Lantern Pharma Inc. (NASDAQ: LTRN), een bedrijf op het gebied van kunstmatige intelligentie (AI) dat zich toelegt op het ontwikkelen van kankertherapieën en het transformeren van de kosten, het tempo en de tijdlijn van oncologiegeneesmiddelen ontdekking en ontwikkeling heeft vandaag aangekondigd dat de FDA een Fast Track-status heeft toegekend aan het kandidaat-geneesmiddel voor onderzoek, LP-184, voor de behandeling van Triple Negative Breast Cancer (TNBC). Dit is de tweede Fast Track-aanduiding die in 2024 voor LP-184 werd ontvangen, na de aanduiding voor Glioblastoma in oktober.
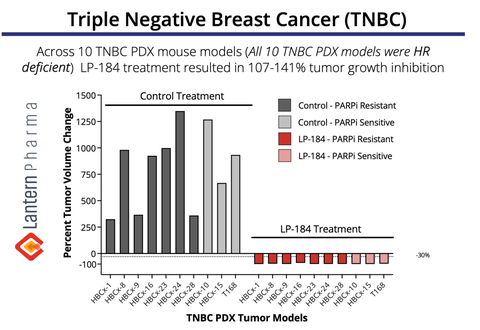
LP-184 vertoonde een tumorregressie van 107-141% in meerdere TNBC PDX-modellen. (Afbeelding: Business Wire)
LP-184 bevindt zich momenteel in een klinische fase 1A-studie die is ontworpen om de veiligheid en verdraagbaarheid van dit synthetisch dodelijke kandidaat-geneesmiddel in een breed scala aan solide tumoren, waaronder TNBC, te evalueren. LP-184 werd gedeeltelijk geoptimaliseerd en geavanceerd met het AI-platform van Lantern, RADR®, dat hielp bij het valideren van mechanismen die in de klinische setting konden worden benut om uitdagende kankers uit te roeien en inzichten te ontdekken in gerichte patiëntenpopulaties.
"Receiving een tweede FDA Fast Track-aanduiding voor LP-184 versterkt het aanzienlijke potentieel van dit kandidaat-geneesmiddel om kritische onvervulde behoeften bij agressieve kankers aan te pakken, vooral die zoals TNBC, waar patiënten beperkte therapeutische opties hebben, "aldus Panna Sharma, president en CEO van Lantern Pharma. "Recente gegevens gepresenteerd op de Immuno-Oncology Summit hebben het vermogen van LP-184 aangetoond om TNBC-tumoren te sensibiliseren die niet reageren op checkpoint-remmers, waardoor de behandelingsopties mogelijk worden uitgebreid voor patiënten met beperkte therapeutische keuzes."
Over TNBC en de behoefte aan nieuwe therapieën
TNBC vertegenwoordigt ongeveer 20% van alle borstkankers en treft jaarlijks bijna 29.000 patiënten in de VS. De prognose voor TNBC-patiënten is aanzienlijk slechter dan voor hormoonreceptorpositieve borstkankers, waarbij meer dan 50% van de patiënten in de eerste 3-5 jaar terugvalt en gemetastaseerde TNBC-patiënten een mediane totale overleving van minder dan een jaar hebben. De momenteel beschikbare behandelingsopties zijn beperkt, vooral voor patiënten die resistentie ontwikkelen tegen bestaande therapieën.
Overtuigende preklinische gegevens tonen het potentieel van LP-184 aan in TNBC
De bovenstaande grafiek toont de opmerkelijke antitumorale activiteit van LP-184 aan in een panel van 10 xenotransplantaten afkomstig van TNBC-patiënten ( PDX)-modellen. Met name vertoonde LP-184 een consistente werkzaamheid bij zowel PARP-resistente als PARP-gevoelige tumoren, waarbij de behandeling resulteerde in volledige tumorregressie (107-141% remming van de tumorgroei) in alle geteste modellen. Deze gegevens zijn bijzonder belangrijk omdat ze wijzen op het potentieel van LP-184 als een nieuwe therapeutische optie voor TNBC-patiënten, inclusief degenen die resistentie hebben ontwikkeld tegen bestaande PARP-remmerbehandelingen - een groeiende klinische uitdaging bij TNBC-therapie. Deze TNBC-gegevens werden voor het eerst gepresenteerd op het San Antonio Breast Cancer Symposium in 2022.
Het unieke werkingsmechanisme van LP-184 wordt aangedreven door de enzymatische activering van het medicijn door Prostaglandine Reductase 1 (PTGR1), dat LP-184 omzet in zijn zeer krachtige cytotoxische vorm, specifiek in kankercellen. RADR®-platformanalyse en daaropvolgende in vivo validatiestudies hebben aangetoond dat PTGR1 vaak verhoogd is in TNBC-tumoren in vergelijking met normaal weefsel, waardoor deze kankers bijzonder gevoelig zijn voor behandeling met LP-184. Deze op biomarkers gebaseerde aanpak maakt de potentiële identificatie mogelijk van patiënten die het meest waarschijnlijk zullen reageren op LP-184-therapie, in lijn met de huidige en opkomende precisiegeneeskundige benaderingen bij de behandeling van TNBC.
Over LP-184
sterk>LP-184 is een kandidaat-medicijn van de volgende generatie en acylfulvene van de volgende generatie, dat bij voorkeur DNA beschadigt in kankercellen die specifieke biomarkers tot overexpressie brengen of mutaties herbergen in herstelroutes voor DNA-schade. LP-184 is ontwikkeld met behulp van het eigen RADR® AI-platform van Lantern om patiëntenpopulaties en kankersubtypen te identificeren die potentieel op de behandeling kunnen reageren. De verbinding wordt geëvalueerd in meerdere solide tumoren, waar het nanomolaire potentie en activiteit heeft aangetoond bij medicijnresistente kankers. LP-184 heeft de status van weesgeneesmiddel ontvangen van de FDA voor de behandeling van pancreaskanker, glioblastoom (GBM) en ATRT, en heeft ook de status Rare Pediatric Disease gekregen voor ATRT.
Over ons Lantaarn Pharma
Lantern Pharma (NASDAQ: LTRN) is een AI-bedrijf dat de kosten, het tempo en de tijdlijn van de ontdekking en ontwikkeling van oncologische geneesmiddelen transformeert. Ons eigen AI- en machine learning (ML)-platform, RADR®, maakt gebruik van meer dan 100 miljard op oncologie gerichte datapunten en een bibliotheek van meer dan 200 geavanceerde ML-algoritmen om reële problemen van miljarden dollars in de ontwikkeling van oncologische geneesmiddelen op te lossen. Door gebruik te maken van de kracht van AI en met de inbreng van wetenschappelijke adviseurs en medewerkers van wereldklasse hebben we de ontwikkeling versneld van onze groeiende pijplijn van therapieën die meerdere kankerindicaties omvatten, waaronder zowel solide tumoren als bloedkanker en een antilichaam-geneesmiddelconjugaat (ADC). ) programma. Onze belangrijkste ontwikkelingsprogramma's omvatten een Fase 2 klinisch programma en meerdere Fase 1 klinische onderzoeken. Onze AI-aangedreven pijplijn van innovatieve productkandidaten heeft naar schatting een gecombineerd jaarlijks marktpotentieel van meer dan $15 miljard USD en heeft het potentieel om levensveranderende therapieën te bieden aan honderdduizenden kankerpatiënten over de hele wereld.
TOEKOMSTGERICHTE VERKLARING:
Dit persbericht bevat toekomstgerichte verklaringen in de zin van Sectie 27A van de Securities Act van 1933, zoals gewijzigd, en Sectie 21E van de Securities Exchange Act van 1934, zoals gewijzigd. Deze toekomstgerichte verklaringen omvatten onder meer verklaringen met betrekking tot: toekomstige gebeurtenissen of onze toekomstige financiële prestaties; de potentiële voordelen van ons RADR®-platform bij het identificeren van kandidaat-geneesmiddelen en patiëntenpopulaties die waarschijnlijk zullen reageren op een kandidaat-geneesmiddel; onze strategische plannen om de ontwikkeling van ons kandidaat-geneesmiddelen en het ontwikkelingsprogramma voor antilichaamgeneesmiddelenconjugaten (ADC) te bevorderen; schattingen met betrekking tot de ontwikkelingstiming voor onze kandidaat-geneesmiddelen en ADC-ontwikkelingsprogramma; verwachtingen en schattingen met betrekking tot de timing van klinische onderzoeken en de inschrijving van patiënten; onze onderzoeks- en ontwikkelingsinspanningen van onze interne programma's voor het ontdekken van geneesmiddelen en het gebruik van ons RADR®-platform om het ontwikkelingsproces van geneesmiddelen te stroomlijnen; onze intentie om gebruik te maken van kunstmatige intelligentie, machinaal leren en genomische gegevens om het tempo, de risico's en de kosten van de ontdekking en ontwikkeling van oncologische geneesmiddelen te stroomlijnen en te transformeren en om patiëntenpopulaties te identificeren die waarschijnlijk zouden reageren op een kandidaat-geneesmiddel; schattingen met betrekking tot patiëntenpopulaties, potentiële markten en potentiële marktomvang; verkoopschattingen voor onze kandidaat-geneesmiddelen en onze plannen om kandidaat-geneesmiddelen te ontdekken en te ontwikkelen en hun commerciële potentieel te maximaliseren door dergelijke kandidaat-geneesmiddelen zelf of in samenwerking met anderen te bevorderen. Alle uitspraken die geen uitspraken zijn over historische feiten (inclusief, maar niet beperkt tot, uitspraken waarin woorden worden gebruikt als ‘anticiperen’, ‘geloven’, ‘overwegen’, ‘kunnen’, ‘schatten’, ‘verwachten’, ‘van plan zijn’, zoeken", "kan", "zou kunnen", "plannen", "potentieel", "voorspellen", "projecteren", "doel", "modelleren", "doelstelling", "doel", "aankomend", "zouden moeten", ""zal", "zou", of het negatief van deze woorden of andere soortgelijke uitdrukkingen) moeten worden beschouwd als toekomstgerichte verklaringen. Er zijn een aantal belangrijke factoren die ertoe kunnen leiden dat onze werkelijke resultaten wezenlijk verschillen van de resultaten die worden aangegeven in de toekomstgerichte verklaringen, zoals (i) het risico dat ons onderzoek en het onderzoek van onze medewerkers niet succesvol zullen zijn, (ii) het risico dat observaties in preklinische onderzoeken en vroege of voorlopige observaties in klinische onderzoeken er niet voor zorgen dat latere observaties, onderzoeken en ontwikkelingen consistent of succesvol zullen zijn, (iii) het risico dat we mogelijk niet in staat zijn om voldoende toekomstige financiering veilig te stellen wanneer dat nodig is en zoals nodig om onze bestaande en geplande klinische onderzoeken en operaties, (iv) het risico dat we er niet in slagen potentiële kandidaten in licentie te geven of potentiële partnerschappen en samenwerkingsverbanden tot stand te brengen, (v) het risico dat geen van onze productkandidaten goedkeuring voor marketing door de FDA heeft gekregen, en dat we dat misschien niet doen in staat zijn om met succes klinische testen te initiëren, uit te voeren of af te ronden voor of marketinggoedkeuring te verkrijgen voor onze productkandidaten, (vi) het risico dat geen enkel geneesmiddel op basis van ons eigen RADR® AI-platform marketinggoedkeuring van de FDA heeft gekregen of anderszins is opgenomen in een commercieel product, en (vii) die andere factoren uiteengezet in het gedeelte Risicofactoren in ons jaarverslag op formulier 10-K voor het jaar eindigend op 31 december 2023, ingediend bij de Securities and Exchange Commission op 18 maart 2024. U kunt ons jaarverslag raadplegen op formulier 10-K voor het jaar eindigend 31 december 2023 onder het tabblad Investeerders SEC-registraties op onze website op www.lanternpharma.com of op de website van de SEC op www.sec.gov. Gezien deze risico's en onzekerheden kunnen we geen garanties geven dat onze toekomstgerichte verklaringen accuraat zullen blijken te zijn, of dat andere resultaten of gebeurtenissen die in onze toekomstgerichte verklaringen worden geprojecteerd of overwogen zich ook daadwerkelijk zullen voordoen, en we waarschuwen beleggers om dit niet te doen. overmatig vertrouwen stellen in deze verklaringen. Alle toekomstgerichte verklaringen in dit persbericht vertegenwoordigen ons oordeel op de datum van dit persbericht, en tenzij anders vereist door de wet, wijzen wij elke verplichting af om toekomstgerichte verklaringen bij te werken om de verklaring in overeenstemming te brengen met de werkelijke resultaten of veranderingen in onze verwachtingen. .
Bron: Lantern Pharma Inc.
Geplaatst : 2024-12-04 06:00
Lees verder

- BJ's Wholesale Club roept zalm terug in zeven staten aan de oostkust
- Fenebrutinib van Genentech is het eerste onderzoeksgeneesmiddel in meer dan tien jaar dat de progressie van invaliditeit bij primaire progressieve multiple sclerose (PPMS) vermindert
- FDA breidt terugroepactie van Tater Tot uit in verband met mogelijke plasticverontreiniging
- Verslechtering van de overactieve blaas gezien bij patiënten die een genderbevestigende vaginoplastie ondergaan
- Bhattacharya gaat dubbele taken vervullen bij Helms of CDC en NIH
- De Amerikaanse Food and Drug Administration accepteert de nieuwe medicijnaanvraag van Bristol Myers Squibb voor Iberdomide bij patiënten met recidiverend of refractair multipel myeloom
Disclaimer
Er is alles aan gedaan om ervoor te zorgen dat de informatie die wordt verstrekt door Drugslib.com accuraat en up-to-date is -datum en volledig, maar daarvoor wordt geen garantie gegeven. De hierin opgenomen geneesmiddelinformatie kan tijdgevoelig zijn. De informatie van Drugslib.com is samengesteld voor gebruik door zorgverleners en consumenten in de Verenigde Staten en daarom garandeert Drugslib.com niet dat gebruik buiten de Verenigde Staten gepast is, tenzij specifiek anders aangegeven. De geneesmiddeleninformatie van Drugslib.com onderschrijft geen geneesmiddelen, diagnosticeert geen patiënten of beveelt geen therapie aan. De geneesmiddeleninformatie van Drugslib.com is een informatiebron die is ontworpen om gelicentieerde zorgverleners te helpen bij de zorg voor hun patiënten en/of om consumenten te dienen die deze service zien als een aanvulling op en niet als vervanging voor de expertise, vaardigheden, kennis en beoordelingsvermogen van de gezondheidszorg. beoefenaars.
Het ontbreken van een waarschuwing voor een bepaald medicijn of een bepaalde medicijncombinatie mag op geen enkele manier worden geïnterpreteerd als een indicatie dat het medicijn of de medicijncombinatie veilig, effectief of geschikt is voor een bepaalde patiënt. Drugslib.com aanvaardt geen enkele verantwoordelijkheid voor enig aspect van de gezondheidszorg die wordt toegediend met behulp van de informatie die Drugslib.com verstrekt. De informatie in dit document is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, waarschuwingen, geneesmiddelinteracties, allergische reacties of bijwerkingen te dekken. Als u vragen heeft over de medicijnen die u gebruikt, neem dan contact op met uw arts, verpleegkundige of apotheker.
Populaire zoekwoorden
- metformin obat apa
- alahan panjang
- glimepiride obat apa
- takikardia adalah
- erau ernie
- pradiabetes
- besar88
- atrofi adalah
- kutu anjing
- trakeostomi
- mayzent pi
- enbrel auto injector not working
- enbrel interactions
- lenvima life expectancy
- leqvio pi
- what is lenvima
- lenvima pi
- empagliflozin-linagliptin
- encourage foundation for enbrel
- qulipta drug interactions
